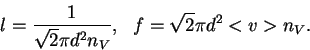-Todos los materiales de la Naturaleza están compuestos por moléculas y átomos.
-Las componentes microscópicas obedecen las leyes de Newton.
-Sus movimientos son aleatorios.
Consideremos N moléculas moviéndose libremente en un recipiente cúbico de lado a, orientado a lo largo de los ejes cartesianos.
Al chocar una molécula con una pared perpendicular al eje x cambia
su momentum en:
Esto es:
Recordando (*), se tiene que:
Se define:
Consideremos un proceso a volumen constante. Por lo tanto W=0. La Primera
Ley da:
Para cambios infinitesimales de temperatura se tiene:
Esta predicción calza bien con los gases reales monoatómicos.
Consideremos un proceso a presión constante. Se tiene:
Para un gas ideal monoatómico se tiene:
En un proceso adiabático no hay intercambio de calor. De la primera
ley:
Se puede mostrar que como consecuencia de la Física clásica, es válido el teorema de Equipartición de la energía mencionado anteriormente. Veamos ahora como se aplica a gases ideales:
i) Molécula monoatómica: 3 grados de libertad(traslación).
![]() .
. ![]() .
.
ii) Molécula biatómica:3 grados de libertad(traslación)+
2 grados de libertad (rotación con un eje invariante),
![]() .
. ![]() .
.
iii)Molécula poliatómica:3 grados de libertad(traslación)+
3 grados de libertad (rotación arbitraria),
![]() ...
...
iv) Molécula diatómica con energía vibracional(resorte):3(t)+2(r)+2(v)=7.
Esto implicaría ![]() , lo que no concuerda con los experimentos.
, lo que no concuerda con los experimentos.
Además ![]() depende de la temperatura, lo que implica que los diferentes grados de libertad
se van excitando a diferentes energías. Esto se puede entender sólo
en el marco de la Mecánica Cuántica.
depende de la temperatura, lo que implica que los diferentes grados de libertad
se van excitando a diferentes energías. Esto se puede entender sólo
en el marco de la Mecánica Cuántica.
-Cuantización de la energía: Se requiere un quantum de energía adecuado para excitar los grados de libertad. Si la temperatura es muy baja sólo los grados de libertad traslacionales contribuyen al calor específico.
v)Para sólidos a altas temperaturas: Los átomos vibran
en torno a sus posiciones de equilibrio. Cada uno tiene una energía:
![]() . Esto es 6 grados de libertad. Esto da
. Esto es 6 grados de libertad. Esto da ![]() (Ley de Dulong-Petit). Esto falla a bajas temperaturas donde se requiere
la Mecánica Cuántica.
(Ley de Dulong-Petit). Esto falla a bajas temperaturas donde se requiere
la Mecánica Cuántica.
Determinemos como varía la presión con la altura sobre la superficie de la Tierra. Suponemos que es un gas ideal y que la temperatura es constante.
Sea y la altura sobre la superficie de la Tierra y ![]() el número de moléculas por unidad de volumen. Se tiene:
el número de moléculas por unidad de volumen. Se tiene:
Para la presión se tiene
Se define el valor promedio
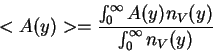
- ![]()
-Energía potencial gravitacional media:![]() .
.
Ejercicio:
Excitación térmica en un átomo con dos niveles.
En 1860 J.C. Maxwell descubrió la ley de distribución de velocidad de las moléculas de un gas.
Sea ![]() tal que el número de moléculas del gas con módulo de
la velocidad entre v y v+dv es:
tal que el número de moléculas del gas con módulo de
la velocidad entre v y v+dv es:
De la Ley de Boltzmann, el número de moléculas(por unidad
de volumen) que tiene energía (cinética), entre E y E+dE es:
Ejercicio:
-Encontrar la velocidad más probable. R:
![]()
-La rapidez promedio. R:
![]()
-La velocidad cuadrática media
![]()
Las velocidades promedio de las moléculas que calculamos más arriba son grandes. Entonces por qué los olores en una pieza demoran un tiempo relativamente largo en detectarse? La razón es que las moléculas chocan entre sí. No se propagan en línea recta.
La distancia promedio recorrida por la molécula entre dos choques sucesivos se llama recorrido libre medio l. Para calcularlo imaginemos que las moléculas tienen diámetro d. Se puede ver que dos moléculas chocarán solamente si la distancia entre sus centros es menor a 2d. En forma equivalente podemos pensar que el choque ocurre entre una molécula de radio 2d y otra puntual.
Consideremos el movimiento de la molécula más grande. Su
rapidez promedio es ![]() . En un tiempo t recorre una distancia
. En un tiempo t recorre una distancia ![]() . Durante este tiempo chocará con un n'umero de moléculas:
. Durante este tiempo chocará con un n'umero de moléculas:
Por lo tanto la distancia entre choques sucesivos es:
-frecuencia de choque f= choques por unidad de tiempo=![]() .
.
-tiempo libre medio=![]() .
.
Hemos supuesto que las moléculas que chocan con la grande son
estacionarias. Si incluimos su movimiento se tiene: