La termodinámica estudia las transferencias de calor y trabajos asociados. Consta de tres leyes fundamentales:
-Ley 0(Definición de Temperatura)
-Primera Ley(Conservación de la energía)
-Segunda ley (Crecimiento de la Entropía)
Es posible entender las causas microscópicas de estas tres leyes en el marco de la Mecánica Estadística
Por experiencia se sabe que muchas propiedades físicas de los cuerpos cambian si los calentamos. Por ejemplo el volumen de una columna de Mercurio aumenta al aplicarle una llama. Con esta observación podemos construir un termómetro elemental que nos permite especificar cuando dos objetos tienen dos temperaturas distintas. (Si pongo en contacto un objeto con el termómetro elemental y espero un tiempo suficiente la columna de Mercurio se estabilizará. Esto define la temperatura del objeto. Naturalmente se supone que el objeto+termómetro están aislados del resto del Universo.)
Para definir temperatura necesitamos introducir dos conceptos básicos:
Contacto térmico
Equilibrio térmico
Dos sistemas físicos están en contacto térmico cuando es posible el intercambio de calor entre ellos. Daremos una definición cuantitativa del calor cuando estudiemos la Primera Ley. Por ahora basta decir que el calor es la forma de energía que se intercambia entre los dos sistemas debido a una diferencia de temperatura entre ellos.
Dos sistemas están en equilibrio térmico cuando, estando en contacto térmico, ya no intercambian energía en forma de calor. Veremos que esto implica que las temperaturas de los dos sistemas son iguales.
Consideremos tres objetos, A,B,C, donde C es un termómetro. Pongo A en contacto térmico con C y espero hasta lograr el equilibrio térmico. Leo la altura del termómetro. Luego hago lo mismo con B. Si las dos lecturas en C coinciden, entonces A y B están en equilibrio térmico. Esto da lugar a la:
Ley Cero de la Termodinámica: Si A y B están en equilibrio térmico con C, entonces A está en equilibrio térmico con B Note que esto define una relación de equivalencia en el conjunto de Sistemas Fí sicos. La propiedad que iguala a los sistemas en equilibrio térmico se llama temperatura. Podemos decir ahora que:
- Si A y B tienen la misma temperatura están en equilibrio térmico.
-Si A y B tienen temperaturas diferentes, no están en equilibrio térmico.
-![]() Celsius: Punto de ebullición del agua: Agua y vapor en equilibrio
térmico a una atmósfera.
Celsius: Punto de ebullición del agua: Agua y vapor en equilibrio
térmico a una atmósfera.
La escala se divide en 100 partes iguales, cada una corresponde a ![]() Celsius.
Celsius.
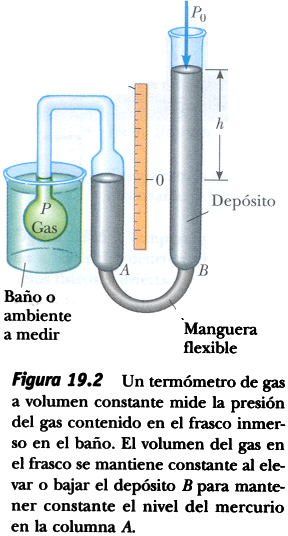
A partir de 1954 se usa como referencia el punto triple del agua: En
este punto coexisten el gas, el líquido y el sólido. Se da
para una única presión y temperatura: ![]() , presión=4.58mm de Hg
, presión=4.58mm de Hg

En algunos países se usa la escala Fahrenheit:
Coeficiente promedio de expansión lineal:
Coeficiente promedio de expansión volumétrica (![]() )
)
Para un sólido se tiene que:

Para describirlas definamos la cantidad de gas en número de moles.
Un mol de cualquier substancia contiene el número de Avogadro
de átomos o moléculas.
![]() . El número de moles n es:
. El número de moles n es:
La ecuación de estado del gas ideal es:
Si la expresión se expresa en atmósferas y V en litros
se tiene ![]() . Por lo tanto el volumen ocupado por 1 mol de cualquier gas a
. Por lo tanto el volumen ocupado por 1 mol de cualquier gas a ![]() C y 1atm es de 22.4 L.
C y 1atm es de 22.4 L.
Si N es el número de moléculas en el volumne V se tiene
que: