A comienzos del siglo XIX la gente estaba interesada en mejorar la eficiencia de las máquinas de vapor y de los cañones. Un hecho evidente era que después de algunos disparos los cañones se recalentaban hasta tal punto que se volvían inservibles. Esto llevó a la observación que debía existir una conexión entre las fuerzas mecánicas y químicas involucradas en el disparo y el "calórico" como se llamaba el calor en esa época.
Fue Joule quie estableció la relación precisa entre energía mecánica y calor.
El calor es transferencia de energía debido a diferencias de temperatura. En este contexto se introduce la caloría:
Una caloría es el calor que se necesita transferir a un gramo de agua, para cambiar su temperatura de 14.5 a 15.5 grados Celsius
Se tiene además: 1Cal=1000 cal.
Joule utilizando una rueda con paletas conectada a un conjunto de poleas con pesos en sus extremos pudo mostrar una relación precisa entre la energía mecánica de los pesos en las poleas y el aumento de temperatura del agua en el recipiente, debido a la rotación de las paletas. Esto da:
1 cal= 4.186 J
La capacidad calorífica de una muestra se define como la cantidad de energía necesaria
para aumentar la temperatura de esa muestra en ![]()
Por lo tanto si una cantidad de calor Q produce un cambio ![]() en la temperatura de una sustancia se tiene:
en la temperatura de una sustancia se tiene:
El calor específico es la capacidad calorífica por unidad de masa
NOTA: En general c(T), por lo tanto:
CONVENCION: Q es positivo si fluye calor hacia el sistema. Q es negativo si el sistema cede calor.
El calor especíco depende de las condiciones externas.
Para gases el calor específico a presión constante (![]() ) es diferente del
calor específico a volumen constante (
) es diferente del
calor específico a volumen constante (![]() ) . Para líquidos y sólidos
no hay gran diderencia entre los dos.
) . Para líquidos y sólidos
no hay gran diderencia entre los dos.
Una técnica para medir el calor específico de una sustancia X consiste en calentar una muestra
hasta una temperatura conocida ![]() , colocarla en un recipiente con agua de masa conocida
, colocarla en un recipiente con agua de masa conocida ![]() y temperatura menor
y temperatura menor ![]() , medir la temperatura del sistema después de alcanzado el equilibrio.
, medir la temperatura del sistema después de alcanzado el equilibrio.
Como el trabajo realizado es despreciable, la conservación de la energía implica:
Sea ![]() la masa de la sustancia X.
la masa de la sustancia X.
Se tiene:
Esto es:
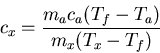
Cuando hay transferencia de calor sin cambio de temperatura(como en una transición de fase) se habla de calor latente L.
La cantidad de calor Q necesaria para cambiar la fase de una masa m de una sustancia pura es:
Calor latente de fusión ![]() : Cambio de fase de sólido a líquido.
: Cambio de fase de sólido a líquido.
Calor latente de vaporización ![]() : Cambio de fase de líquido a gas.
: Cambio de fase de líquido a gas.
Consideremos un gas contenido en un recipiente cilíndrico de área transversal A, con un émbolo.
Al expandirse el gas hace un trabajo sobre el émbolo dado por
CONVENCION: ![]() : Trabajo hecho por el sistema;
: Trabajo hecho por el sistema;
![]() trabajo hecho sobre el sistema.
trabajo hecho sobre el sistema.
El trabajo depende de los estados intermedios para llegar de ![]() y no sólo de i y f.
y no sólo de i y f.
Ver figura:
Si la cantidad Q-W se mide para diferentes trayectorias que conectan los estados de equilibrio i y f, se encuentra un único resultado. Por lo tanto esta cantidad está determinada por completo por i y f. Si U representa la energía interna, se tiene:
Si se trata de un cambio de estado infinitesimal, se tiene que:
Proceso isobárico: P=constante.
Proceso isovolumétrico: V=constante.
Proceso Isotérmico: T=constante.
Expansión isotérmica de un gas ideal
El trabajo realizado al expandirse de ![]() a
a ![]() es:
es:
Conducción térmica
Si los dos extremos de un material de área transversal A separados por una distancia dx se encuentran a diferente
temperatura, habrá un flujo de calor ![]() durante un instante
durante un instante ![]() , desde el
lado más caliente al más frío, dado por:
, desde el
lado más caliente al más frío, dado por:
Ej: Para una barra uniforme de largo L, aislada en el manto se tiene que:
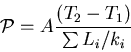
Aislamiento de casas
En aplicaciones de Ingeniería se introduce el valor R de un material:
Es calor transferido por corrientes de material.
Calor radiado por un objeto por unidad de tiempo:
Ley de Stefan:
La emisividad es la fracción de la energía entrante que la superficie absorbe. e varía entre 0 y 1.
Cuando un cuerpo está en equilibrio con su entorno, su temperatura no cambia y emite tanta energía como la que absorbe.
En una noche nublada, la superficie de la Tierra pierde menos energía por radiación que en una noche clara. Por eso las noches claras son más frías.
El frasco Dewar
Así funcionan los termos. Está hecho de un recipiente con doble pared de vidrio con paredes plateadas. Entre las dos paredes de vidrio se hace vacío para minimizar la pérdida de energía por convección. Las paredes plateades evitan la pérdida por radiación, debido a que la Plata es un buen reflector y tiene baja emisividad.