Un refrigerador es una máquina de calor que funciona a la inversa. Esto es : Absorbe calor de un depósito a temperatura
![]() y libera calor a un depósito a mayor temperatura
y libera calor a un depósito a mayor temperatura ![]() . Para lograr esto debe hacerse un trabajo W sobre
el sistema. La experiencia muestra que esto es imposible hacerlo con W=0.
. Para lograr esto debe hacerse un trabajo W sobre
el sistema. La experiencia muestra que esto es imposible hacerlo con W=0.
Se define la eficiencia de un refrigerador como:
Segunda Ley de la Termodinámica (enunciado de Clausius): Es imposible construir una máquina cíclica cuyo único efecto sea la transferencia continua de energía de un objeto a otro de mayor temperatura sin la entrada de energía por trabajo.
Se puede mostrar que estos enunciados de la Segunda Ley son equivalentes.
Una máquina térmica cualquiera no puede superar la eficiencia de una máquina de Carnot funcionando entre dos depósitos de energía idénticos.
Para ver esto, considere dos máquinas térmicas que operan usando los mismos depósitos de energía. Una es una máquina de Carnot, con eficiencia ![]() , y
la otra tiene eficiencia
, y
la otra tiene eficiencia ![]() . La máquina más eficiente se usa para hacer funcionar la máquina de Carnot
como un refrigerador de Carnot. Para hacer esto se equipara la salida en trabajo de la máquina más eficiente
con la entrada en trabajo del regrigerador. El efecto neto es transferir calor del depósito frío al caliente
sin realizar trabajo. Esto viola la Segunda Ley (Clausius). Lo que distingue el ciclo de Carnot (que veremos inmediatamente)
es que es reversible. Por lo tanto, el mismo argumento expuesto más arriba muestra que todos los ciclos reversibles
igualan la eficiencia del ciclo de Carnot (nunca la superan).
. La máquina más eficiente se usa para hacer funcionar la máquina de Carnot
como un refrigerador de Carnot. Para hacer esto se equipara la salida en trabajo de la máquina más eficiente
con la entrada en trabajo del regrigerador. El efecto neto es transferir calor del depósito frío al caliente
sin realizar trabajo. Esto viola la Segunda Ley (Clausius). Lo que distingue el ciclo de Carnot (que veremos inmediatamente)
es que es reversible. Por lo tanto, el mismo argumento expuesto más arriba muestra que todos los ciclos reversibles
igualan la eficiencia del ciclo de Carnot (nunca la superan).
Considere un gas ideal.
1. Proceso ![]() es una expansión isotérmica a
es una expansión isotérmica a ![]() . Se absorbe energía
. Se absorbe energía ![]() y se realiza un trabajo
y se realiza un trabajo ![]() .
.
2. Proceso ![]() es una expansión adiabática. La temperatura del gas disminuye a
es una expansión adiabática. La temperatura del gas disminuye a ![]() y realiza un trabajo
y realiza un trabajo ![]() .
.
3. Proceso ![]() es una compresión isotérmica a
es una compresión isotérmica a ![]() . Se libera energía
. Se libera energía ![]() hacia el depósito, y el trabajo realizado sobre el gas
es
hacia el depósito, y el trabajo realizado sobre el gas
es ![]() .
.
4. Proceso ![]() es una compresión adiabática. La temperatura del gas aumenta a
es una compresión adiabática. La temperatura del gas aumenta a ![]() y el trabajo efectuado sobre el gas es
y el trabajo efectuado sobre el gas es
![]() .
.
El trabajo neto realizado por el gas en este proceso cíclico es el área encerrada en la figura.
Mostraremos que la eficiencia de una máquina de Carnot es:
En ![]() se tiene:
se tiene:
En ![]() se tiene:
se tiene:
Notar que los Q de una máquina térmica se consideran positivos.
Por lo tanto:
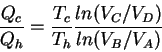
Por lo tanto:
lo que implica:
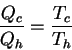
Un motor de gasolina se aproxima usando el ciclo de Otto:
1. Durante la carrera de admisión ![]() el pistón se mueve hacia abajo, y una
mezcla gaseosa de aire y combustible se introduce en el cilindro a presión atmosférica. El volumen aumenta de
el pistón se mueve hacia abajo, y una
mezcla gaseosa de aire y combustible se introduce en el cilindro a presión atmosférica. El volumen aumenta de
![]() a
a ![]() .
.
2. Durante la carrera de compresión ![]() el pistón se mueve hacia arriba, la mezcla de aire-combustible se comprime
adiabáticamente del volumen
el pistón se mueve hacia arriba, la mezcla de aire-combustible se comprime
adiabáticamente del volumen ![]() al
al ![]() y la temperatura aumenta de
y la temperatura aumenta de ![]() a
a ![]() . El trabajo realizado
por el gas es negativo.
. El trabajo realizado
por el gas es negativo.
3. En ![]() la combustión ocurre cuando se enciende la chispa de la bujía. Esta no es una de las carreras
del ciclo
porque ocurren en un período muy breve. La temperatura y presión del gas aumentan considerablemente, pero el
volumen permanece prácticamente constante, por lo que el gas no realiza trabajo.
la combustión ocurre cuando se enciende la chispa de la bujía. Esta no es una de las carreras
del ciclo
porque ocurren en un período muy breve. La temperatura y presión del gas aumentan considerablemente, pero el
volumen permanece prácticamente constante, por lo que el gas no realiza trabajo.
4. En la carrera de potencia(expansión) ![]() , el gas se expande adiabáticamente de
, el gas se expande adiabáticamente de ![]() a
a ![]() , con un descenso
de temperatura de
, con un descenso
de temperatura de ![]() a
a ![]() .
.
5. En el proceso ![]() una válvula de escape se abre conforme el pistón alcanza el final de su viaje y la
presión disminuye repentinamente.
una válvula de escape se abre conforme el pistón alcanza el final de su viaje y la
presión disminuye repentinamente.
6. En la carrera de escape ![]() el pistón se mueve hacia arriba mientras la válvula de escape permanece abierta.
Los gases reciduales se expulsan a presión atmosférica y el volumen disminuye
de
el pistón se mueve hacia arriba mientras la válvula de escape permanece abierta.
Los gases reciduales se expulsan a presión atmosférica y el volumen disminuye
de ![]() a
a ![]() .
.
Si se representa la mezcla aire-combutible por un gas ideal, se tiene la eficiencia del ciclo de Otto:
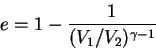
Trabajo neto(Primera Ley):
Pero:
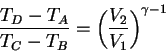
Coeficiente de realización(CDR):
Ahora definimos una nueva función de estado:
Para un ciclo reversible se tiene que:
Para un ciclo de Carnot se tiene:
Dado que la entropía es una función de estado, se tiene, para todo ciclo
reversible:
i(![]() )->f(
)->f(![]() ):
):
Se debe elegir un proceso reversible que conecte los estados inicial y final.
Segunda Ley: La entropía total de un sistema aislado que se somete a un cambio nunca puede disminuir
Proceso reversible: ![]()
Proceso irreversible: ![]() .
.
Muerte Térmica del Universo: Temperatura y densidad uniformes.